全球疫情形势发展令人忧虑,但新冠肺炎的真正“解药”却仍然“下落不明”。曾被寄予厚望,甚至被人们调侃音译为“人民的希望”的抗病毒药物瑞德西韦(remdesivir),其全球范围内的多项临床试验仍未正式对外公布任何结果。

据报道,查询临床试验网站clinicaltrials.gov显示,瑞德西韦在中国新冠肺炎成人重症试验状态为“终止”,原因显示为:“中国新冠肺炎疫情已经得到良好控制,当前没有符合条件的患者入组。”同时,瑞德西韦在中国的新冠肺炎成人轻症和中度症状组的临床试验状态也已更新为“暂停”,原因显示为:“当前,新冠肺炎疫情已得到良好控制,没有符合条件的患者入组。”
4月16日,吉利德方面向红星新闻确认,由于入组人数低,由中国研究机构牵头的瑞德西韦针对新型冠状病毒肺炎重症患者和轻中症患者的两项临床研究已提前终止。吉利德公司同时向红星新闻透露,目前全球范围内共启动了7项临床试验以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性。
另据美国一家生物医药科技垂直媒体STAT报道称,美国芝加哥的一家医院正在进行瑞德西韦这款药物的临床试验,用其治疗新冠肺炎重症患者。该试验发现,使用瑞德西韦后,发热和呼吸道症状可迅速恢复,几乎所有患者均在不到一周的时间内出院。
4月20日,红星新闻记者采访了美国得克萨斯农工大学药物搜索中心主任刘文设。红星新闻此前报道,他是全球范围内较早一批提出瑞德西韦可能对新冠病毒有抑制作用的学者。刘文设告诉红星新闻,该临床试验情况是被泄露出来的,从美国法律角度看此行为涉嫌违法。
另从已被报道的信息来看,该实验本身属于单臂临床实验,缺乏对照组,客观来说该实验数据置信度不如双盲实验。“不过我们还是能看出来,实验者对于实验结果非常兴奋,可以说是比较有希望的。”

瑞德西韦在全球启动7项临床试验
但中国试验已显示终止
据全球最大的临床试验注册机构ClinicalTrials.gov PRS,中日友好医院副院长、中华医学会呼吸病学分会副主任委员曹彬牵头于2月3日开始进行一项随机、双盲、安慰剂对照的多中心的III期临床研究,以评估瑞德西韦的疗效和安全性。总样本量预估为270例,入组轻、中度新冠肺炎患者,试验预期于4月27日结束。

曹彬
该项试验于中国新冠肺炎疫情处于上升期时开始,其试验结果饱受人们期待。在等待临床试验进行的时间里,瑞德西韦被戏称为“人民的希望”,甚至有不少夸张言论称入组临床试验的新冠肺炎患者用上瑞德西韦以后症状迅速改善。然而,对于精心设计的双盲实验来说,上述言论实在有违科学精神,不久便有数名专家对“迅速起效论”进行了批评和辟谣。
随着中国疫情形势持续向好,确诊患者不断被治愈,越来越多的药物被投入临床治疗,瑞德西韦这款药物关注度开始持续下降。红星新闻查询百度搜索指数后注意到,关键词“瑞德西韦”的搜索指数(一种体现互联网用户对关键词关注水平的指数)在2月1日~2月17日呈现较高关注水平,于2月6日抵达搜索指数峰值395930。2月6日后至今,关键词“瑞德西韦”搜索指数呈断崖式下跌,于2月18日跌破20000,并在大多数时候徘徊在10000上下。
中国逐步走出疫情阴霾,全球的疫情形势却急转直下。在新冠肺炎全球大流行的背景下,疫苗和特效药依旧是抗击新冠肺炎的重要武器,全球公共卫生的首要任务正是寻找、研发和实验。
吉利德公司向红星新闻介绍说,目前全球范围内共启动了7项临床试验以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性。红星新闻注意到,这其中包含了中国在二月初启动的由曹彬教授牵头的两项对重症和中症患者的药物临床试验研究。吉利德方面称,这是有关瑞德西韦这款药物最早的两项临床试验。
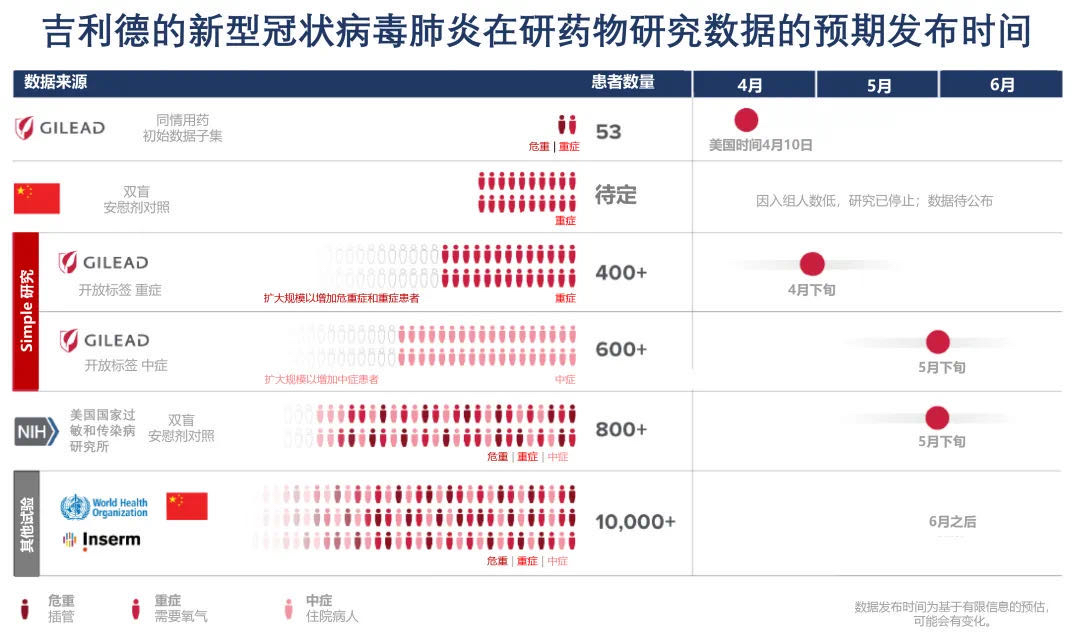
此图中可以看到瑞德西韦各项试验的汇总和预期的数据公布时间 图据吉利德科学
4月11日,研发了瑞德西韦这款药物的吉利德公司于官方微信公众号【吉利德科学】上披露称,中国针对重症患者的瑞德西韦药物临床试验研究已停止。而据第一财经4月16日报道,尽管瑞德西韦中国的临床试验宣布停止,但是重症组已经收集到有效数据,相关结果有望于近期公布。
4月16日,红星新闻向吉利德公司求证了上述信息,吉利德方面向红星新闻回应说,“吉利德只是被告知,由于入组人数低,由中国研究机构牵头的瑞德西韦针对新型冠状病毒肺炎重症患者和轻中症患者的两项临床研究已提前终止。”
红星新闻尝试向曹彬教授了解关于上述两项临床研究终止的更多信息,截至发稿未获回复。

美国吉利德公司
为何入组人数少?
曹彬曾透露中国试验设计更为严格
美国得克萨斯农工大学药物搜索中心主任刘文设向红星新闻分析说,他认为中国瑞德西韦临床试验终止的原因主要有两点:
中国的瑞德西韦临床试验上马后,又迅速涌出大量其他临床试验,确实在客观上挤兑了瑞德西韦临床试验的患者资源;
另一方面,受传统文化观念影响,危重症患者在“无药可医”只能选择成为临床试验者拼死一搏时,会倾向于选择自己比较熟悉的中成药,而非瑞德西韦这种陌生的化学药。
对于刘文设教授所认为的“挤兑患者资源”一说,《新英格兰医学杂志》国内官方微信公众号【NEJM医学前沿】曾表达过类似观点。4月10日,【NEJM医学前沿】发表文章称:
“截至4月10日,我国医疗机构针对新冠肺炎,在‘中国临床试验注册中心’注册了274项干预性临床试验。我们曾在2月12日发文,对临床试验乱象表示忧虑,呼吁严格执行伦理审查,‘减少资源浪费,确保患者权利和安全’。彼时,同类临床试验注册数量是74项(含clinicaltrials.gov注册的数项)。一些设计严谨的高质量临床试验,由于患者分流而遇到入组困难;随着疫情得到迅速控制,入组更无从谈起。”
东南大学人文学院医学人文系副教授程国斌则有不同观点,他撰文认为,瑞德西韦实验病人招募困难的状况,的确在一定程度上是受到了其他临床实验的影响,但其原因并非一般媒体所说的那样——无价值的实验挤兑了病人资源,而是因为:
第一,在抗击疫情的紧急情况下,没有足够多的研究人员和时间来对实验资源进行精细化的分类、筛选和管理;
第二,实验自身的设计方案,导致能够符合要求的病人本身数量就较少。
实际上,曹彬教授自己就曾在访谈中介绍说明,瑞德西韦中国版实验设计是比国际版实验更加严格。红星新闻注意到,“相比更严格”,主要指的是这样一条:
在中国版实验设计中,实验者要求入组患者在参加试验之前30天没有接受任何针对新冠病毒的实验性药物治疗(超说明书用药,同情用药或试验相关药物);
而在国际版实验设计中,实验者仅要求入组患者在研究药物给药前24小时内,禁止与其他具有实际或可能直接作用的抗SARS-CoV-2抗病毒活性药物同时治疗。

国外试验数据显示:
患者在接受瑞德西韦治疗后6天出院
专家认为:
试验数据缺乏对照组
按照吉利德公司的预期,原本4月底便有望获得瑞德西韦针对重症患者研究的初步数据,并对其进行解读和分享结果。然而随着“研究停止”,吉利德公司表示“期待在适当的时候看到公布的数据”。
目前唯一公开的有关瑞德西韦作用于新冠肺炎患者的数据,来自于4月11日吉利德科学公司发表在《新英格兰医学杂志》上的一篇文章。美国时间2020年4月10日,吉利德科学公司宣布了一项队列分析的结果,数据针对53名新型冠状病毒肺炎严重并发症的住院患者,他们以个例同情用药的方式,接受了在研抗病毒药物瑞德西韦的治疗。在这53名来自全球的患者中,大多数患者获得了临床改善,且没有提示新的关于瑞德西韦安全性的信号。
文章显示,首次使用瑞德西韦后18天的中位随访期内,68%接受瑞德西韦治疗的患者(n=36/53)的氧气支持水平得到改善。超过一半的需要机械通气的患者可以拔管(57%,n=17/30),所有患者中近一半(47%,n=25/53)在接受瑞德西韦治疗后出院。
该篇文章的作者,洛杉矶西达赛奈医疗中心流行病医院院长,医学博士Jonathan D. Grein表示,“目前,针对新型冠状病毒肺炎尚无已经被证实的治疗方法。我们无法从这些数据中得出明确的结论,但是观察接受瑞德西韦治疗的这组住院患者,我们获得的结果是有希望的。”

不过,4月16日美国生物医药科技垂直媒体STAT披露的一份非公开资料或许能让大众得以窥见国际层面瑞德西韦临床试验的最新进展。STAT报道称,美国芝加哥一家医院正在进行瑞德西韦这款药物的临床试验,用其治疗新冠肺炎重症患者。该试验发现,使用瑞德西韦后,发热和呼吸道症状可迅速恢复,几乎所有患者均在不到一周的时间内出院。
据STAT报道,芝加哥大学医学院招募了125名Covid-19患者进入吉利德的两项3期临床试验,其中有113名患者属于重症,并且所有患者都每日注射瑞德西韦进行治疗。随着实验终止,最终有两名患者死亡,其余患者全部出院,大多数患者都在接受瑞德西韦治疗6天后出院。使用瑞德西韦治疗后,患者的发热症状得到迅速控制,更有患者在开始治疗一天后便撤下了呼吸机。
值得注意的是,STAT获悉上述内容的途径是一份芝加哥大学内部视频讨论的副本。该视频本是负责医院瑞德西韦研究的芝加哥大学传染病专家Kathleen Mullane与芝加哥大学其他教师进行关于上述试验结果的视频讨论,然而该内部视频却外泄给了媒体。
刘文设告诉红星新闻记者,该临床试验情况是被泄露出来的,从美国法律角度看此行为其实涉嫌违法,“按照FDA的规定,严格意义上来说,在临床试验结束之前,实验者是不允许对外通报任何信息的。”
刘文设还强调,另从已被报道的信息来看,该实验本身属于单臂临床实验,缺乏对照组,客观来说该实验数据置信度不如双盲实验。
实际上,芝加哥大学也在一份声明中明确指出:“在这一点上得出任何结论还为时过早,而且在科学上是不合理的。”STAT自己也表示,研究中缺乏控制臂,可能会使解释结果更具挑战性。
针对上述实验数据,斯克里普斯研究转化研究所所长埃里克·托普尔(Eric Topol)表示其“令人鼓舞”,但从随机对照研究中获得更多数据非常重要。
“我们能看出来,实验者对于实验结果非常兴奋,可以说是比较有希望的。”刘文设表示,针对在重大恶性疾病的药物临床试验设计上,遵循科学严谨性和照顾伦理常是两难的,如果严格制定双盲实验,必定会有一半试验者被随机分配到对照组。对于这部分对照组的患者,研究者们并不能忍心眼睁睁的看着他们因为没有使用药物而病情恶化,所以为了关照伦理,这类试验在很多时候会被设计为单臂实验。


