每经记者 陈星 每经编辑 程鹏 梁枭

2021年4月2日,一位北京大学第三医院(以下简称北医三院)肿瘤内科医生张煜在知乎发帖,公开质疑同行“蓄意诱骗治疗“,导致“患者生存期明显缩短,家属花费了常规治疗 10 倍以上“。同时,张煜医生揭露其中存在的诸多问题,阐述了目前的肿瘤治疗乱象,并提出可能的解决方式。

4月13日,张煜再发文,请求国家尽早设立医疗红线并严厉监督执行,任何明确违规且损伤患者生命权益的不良医疗行为,必须从重从快处罚。

4月18日,张煜医生再度发文,指出肿瘤治疗经常是人财两空,而这样的悲剧很多都是医生造成的,“监督力度缺乏,导致某些医生肆意妄为……部分医生作恶的后果由全体国民一同承受,这非常不公平”。4月18日晚间,迫于比预想还要更大的压力,张煜医生删掉了自己的文章。
此事引起了舆论地广泛关注。
4月19日晚间,国家卫健委回应称,立即组织对有关情况和反映的问题进行调查核实,绝不姑息。
《每日经济新闻》记者在实际采访研究过程中发现,超适应症使用抗肿瘤药物在肿瘤治疗中由来已久。有三甲医院肿瘤医生对记者表示,超适应症用药有时也是“无奈之举”。(学术定义上,“超适应症用药”是指医生用药超出了药品说明书的适应症范围。然而在临床上,“超适应症用药”的情况却并不少见。)
从市场层面来看,随着抗癌创新药的大量上市,药企的商业化竞争也进入白热化,这难免会助推跨适应症用药,在这个灰色空间内,界限并不明确。
肿瘤医生发文“揭开”隐秘利益链
4月18日,北京大学第三医院医生张煜在知乎上的言论引爆舆论。
在那篇已被删掉的文章中,身为肿瘤内科医生的张煜“吐槽”了当前肿瘤治疗中的诸多乱象。他认为,胡乱更改标准治疗方案是肿瘤治疗中危害最大的一种行为。很多抗肿瘤药物本身非常好,却被一些医生甚至三甲医院医生滥用。
在文章中,张煜列举了许多临床实例来揭露“无良医生”的惯用做法,每项都令网友瞠目结舌。例如,有医生在对胃癌和肠癌患者进行术后辅助化疗时,用洛铂替代标准的奥沙利铂,用雷替曲塞和被淘汰的去氧氟鸟苷替代标准的5-Fu类药物,导致病人复发转移率不同程度升高;也有医生在对肠癌根治术后III期患者时,没有任何指证就在化疗基础上加用贝伐珠单抗/西妥昔单抗,甚至加上没有被批准用于治疗肠癌的安罗替尼或阿帕替尼,造成复发转移率轻度增加,死亡率增加;更有医生在对明确不需要化疗的患者时,故意夸大病情并采用辅助化疗,尽管这样做只能给患者带来伤害,甚至可能增加复发转移风险……
而对于张煜列举的诸多药物,记者注意到,近年来大火的PD-1抑制剂赫然位列其中。张煜在文章中写道,胃癌术后、胰腺癌术后、肠癌术后、胆管癌术后明确不需要进行PD-1抑制剂治疗的患者,有医生错误地告知患者可以明显增加疗效,从而诱导这些患者进行PD-1抑制剂治疗。
张煜的言论使PD-1跨适应症用药的话题重回大众视野。
事实上,早在2019年就有研究者发现,并不是所有患者都适用免疫治疗,在EGFR突变的患者中,就出现后线使用PD-1治疗不但没有控制住病情,反而加快恶化并迅速死亡的案例。
张煜在文章中阐述了目前的肿瘤治疗乱象,提出可能的解决方式,并请求国家尽早设立医疗红线,遏制肿瘤治疗中的不良医疗行为。
在文章引起巨大讨论后,张煜更新了知乎发文。他在更新后的文章中称:“多数肿瘤有标准的初始一线治疗和二线治疗方案,经过反复临床探索和研究证实有效。医生无权随意给肿瘤患者制定独特的初始一线治疗方案,但是在标准方案反复失败之后,可以详细交代患者病情取得理解后,制定独特的新方案……但如果是刚诊断患者的一线治疗,必须遵守指南规范,想不遵守可以,医生需要发起临床试验,经过伦理委员会批准,并且要免费给患者使用,这是标准程序,非常严格。”
新华社发文
:删了帖子但删不了问题
官方回应:
立即开展调查
4月19日下午,新华社主办的《新华每日电讯》发表评论指出,删了帖子但删不了问题,“任何行业的健康发展,都离不开一双双监督的眼。……不解决问题却解决‘提问题的人’,只会连累整个行业,最后积重难返。”
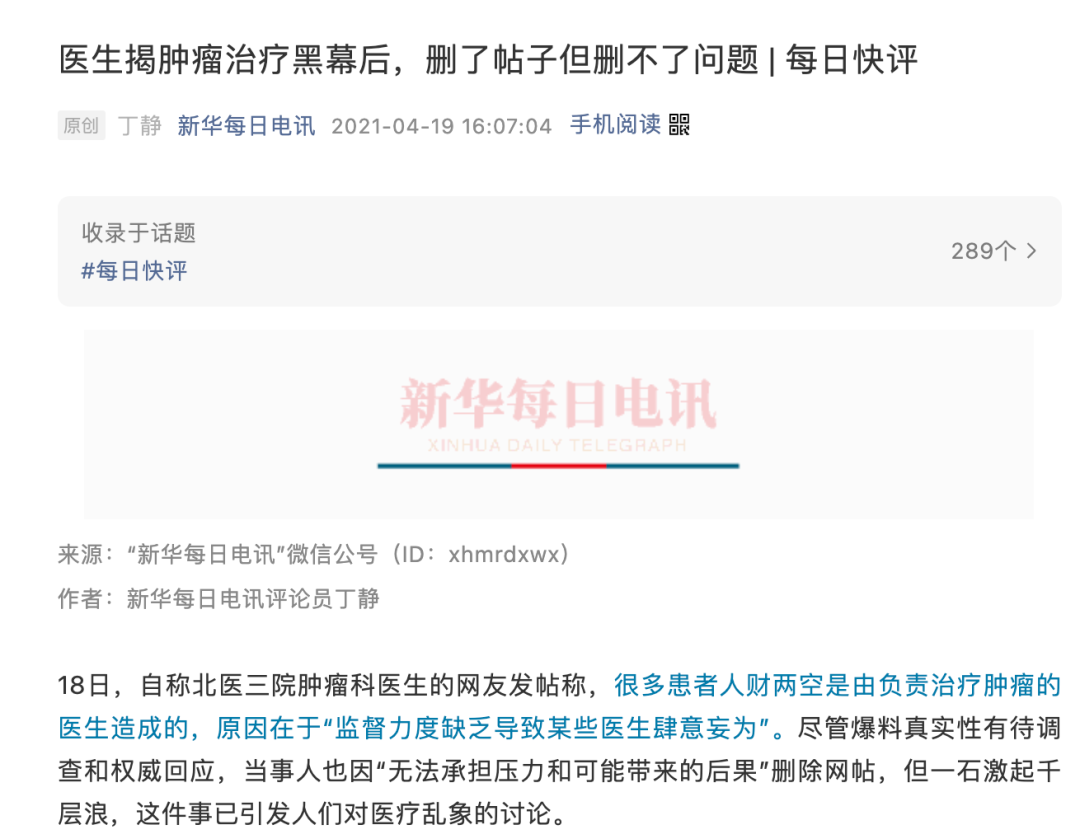
4月19日晚间,国家卫健委对此回应称,关注到“北医三院肿瘤内科医生反映肿瘤治疗黑幕”有关网络信息,立即组织对有关情况和反映的问题进行调查核实,绝不姑息。
国家卫健委还表示,下一步,将持续推进肿瘤诊疗管理工作,进一步健全管理制度规范体系,加大监督指导力度,确保相关要求落实到位,着力提升肿瘤诊疗规范化水平,维护人民群众健康权益。

明星抗癌药被“超纲使用”常见于临床
广东省人民医院副院长吴一龙曾表示,新药上市需要国家药品监督管理局根据临床试验结果审批,每个药都有各自获批的适应症,国家规定必须按照适应症来使用药物,但是临床上超适应症使用的情况普遍存在。
四川省某肿瘤医院的临床医生汪林(化名)在接受《每日经济新闻》记者采访时也表示,很多时候,肿瘤用药其实是在“冒险”。“‘冒险的’不仅仅有病人,还有医生。因为已有的治疗规范是针对已经明确的肿瘤病症与治疗的,但对于很多存在未知或复杂情况的癌症治疗来说,既定的治疗规范不一定可以参考。因此,摆在医生和患者面前的只有一条路,就是‘试’”。
张煜质疑的重点之一是一个在其看来不恰当的治疗方案——用卡培他滨、奥沙利铂、培美曲塞、安罗替尼及他莫昔芬等药物治疗胃癌患者。张煜认为,上述培美曲塞、安罗替尼、乳腺癌用药他莫昔芬等均属于超适应症用药,不应该用于胃癌病例的治疗。而在患者家属微博中提到的3万元一次的NKT免疫治疗,除了临床试验外,并没有批准进入临床使用。
对此,汪林表示,其也在不同的病例身上使用过超适应症的用药。“这一点其实跟上面提到的理由类似,因为很多肿瘤患者的情况不一定跟用药规范上的情况上完全一致,甚至在实践中能遇到很多规范上没有提到的情况。这种情况下,医生只能查询相关的文献,看对应症状曾使用过什么药物。这些药物的使用可能是根据文献案例来的、可能是根据同行交流而来,也有可能是根据医生的诊疗经验得来,但它们并没有写进用药规范或药物说明书中”。
“但这不代表,这样用药是医生为了牟利,明知无效而故意为之。这种画等号的行为在我个人看来是不能接受的。”汪林强调。他还举例称,自己曾经为治疗某预判非常不好的肿瘤病人,而建议使用还在临床试验阶段未上市的药物,结果却被这位病人家属投诉到院办。“遇到这种情况,其实医生也很无奈”。
实际上,肿瘤的疾病特点决定了多数的肿瘤治疗缺乏标准化的方案,医生的个体化精准治疗在肿瘤治疗上十分常见。因此,肿瘤药物的超适应症使用现象也非常普遍。在全球范围内,美国、德国、意大利等国家均允许超适应症用药。
在我国,国家卫健委组织原国家卫生计生委合理用药专家委员会牵头制定了《新型抗肿瘤药物临床应用指导原则(2018年版)》(以下简称《原则》),为医生面临特殊情况时指明了合理用药的底线。在“特殊情况下的药物合理使用”一部分,《原则》明确,在尚无更好治疗手段等特殊情况下,医疗机构应当制定相应管理制度、技术规范,对药品说明书中未明确但具有循证医学证据的药品用法进行严格管理。
也就是说,在国外已经获批的适应症但国内暂未获批的,仍可以在特殊情况下给予患者用药。
吴一龙也曾阐述过同样的看法。他表示,由于临床上超适应症使用的情况普遍存在。因此针对这个问题,我国将超适应症重新定义为特殊情况下的使用,其含义是如果一个药在国际上已经有临床试验结果,国际上也已经有药品监管部门批准适应症,而中国因为各种情况,导致药物已经上市但某些适应症还没有获批,在这种特殊情况下是可以使用的。
但吴一龙也强调,如果一个药在国外和国内都没有获批适应症,即使是病人要求,临床医生也不可以使用。原因是没有循证医学的证据,这是非常重要的临床决策依据。
汪林对记者强调称,超适应症用药应该从患者利益出发,严格遵循国家权威机构发布的指南、共识以及循证医学的结果,存在严格的备案审批流程,确保患者用药安全,且在患者知情的情况下进行。“但这一点非常依赖于医生的专业素养与个人品德,没有透明规范的统一标准去衡量医生的超适应症用药是否合理”。
“在我看来,超适应症用药更像是‘剑走偏锋’,可能收获意外之喜,但也可能因为没有足够的案例经验和临床依据,最后造成心理、生理和经济的多重打击。”汪林最后说道。
暗藏抗癌创新药市场之争,药企避而不谈
实际上,政策对于超适应症用药的规范一直在路上。
2020年8月,国家药监局药品评审中心公布了一则针对生物类似物适应症外推的技术指导原则。该原则明确指出,生物类似药不能自动外推参照药的全部适应症,外推需要根据所有证据进行科学证明。这一规定被业内认为给生物类似药研发企业泼了一盆“冷水”。
有业内人士曾表示,生物类似药在获批一种适应症后,在临床“外推”适应症,也就是将原研药所有适应症套用在自己身上,是非常常规的操作,有助于相关产品快速扩大市场。而以CDE发布上述指导原则为开端,国产生物类似药临床使用管理将越来越规范,这对这些产品的市场扩张也将形成挑战。
同样的命运也降临在抗肿瘤药身上。有临床专家认为,抗肿瘤药实际上还存在未知不确定性。因此,适应症外推必须具有充分的证据支持,规范的监测,以减少生物类似药在临床应用中的潜在风险。
然而,在适应症数量很大程度上决定了药品市场规模的背景下,超适应症用药成为一个并不少见的现象。以PD-1为例,在PD-1竞争日趋激烈的今天,抢占适应症成为各家药企抢占市场份额的重要手段,通过营销扩大适应症使用范围的现象也屡次出现。
2018年,信达生物旗下PD-1抑制剂信迪利单抗注射液(达伯舒)上市时,就曾因涉及宣传除获批适应症以外的癌症种类引发非议。
彼时,达伯舒上市时的获批适应症为用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤,属于小癌种。但当时有自媒体在宣传达伯舒时写道,“不仅限于淋巴瘤,包括肺癌、肝癌、胃癌等多项癌种都在信迪利单抗的临床范围内。信迪利单抗在肺癌一线治疗方面的Ib期临床数据也可圈可点:针对非鳞非小细胞肺癌,信迪利单抗+培美曲塞/顺铂的客观缓解率达到68.4%;针对鳞状非小细胞肺癌,信迪利单抗+吉西他滨/铂类的客观缓解率达到64.7%,疾病控制率达到100%。”这种超适应症的宣传曾给达伯舒引来不少质疑。
同样的情况还出现在旗下PD-1单抗药物特瑞普利单抗注射液(拓益)身上。上市时,拓益仅获批一个适应症即用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。在今年以前,这也是拓益获批的唯一一个适应症。在我国,黑色素瘤患病人数虽然增长迅速,但总体而言仍属于小癌种。根据弗若斯特沙利文分析,2019年中国黑色素瘤新发病人数为7563人,发病率较低。2019年新发黑色素瘤病人中,既往标准治疗失败后的局部进展或转移性黑色素瘤患者仅2400人,对应的市场规模较小。而目前,拓益在国内的零售价为7200元/240mg,考虑援助方案后第一年费用为10.08万元。以10.08万元/年的费用计算,2019年的新增市场约2.4亿元。财报数据显示,2019年君实生物PD-1产品销售额为7.74亿元,2020年全年则超10亿元。由此看来,可能存在有其他病种的病人使用拓益的情况。

曾有业内人士接受媒体采访表示,在合理用药监管不严时,部分药品超适应症用药的收入,甚至可以达到总收入的40%。
眼下,PD-1的竞争势头愈演愈烈。据研报统计,预计未来2~3年,全球上市PD-1产品将可能超过20个。中国是PD-1研发最为火热的地区,全球154个在研PD-1中,85个由中国企业研发或合作开发,占比达到55%。
在此情况下,PD-1市场空间一再缩水,价格一降再降。谁获批的适应症最多、产能最大、商业化能力最强,将具备显著先发优势。有接近国内PD-1厂商人士对《每日经济新闻》记者表示,临床医生在开具药物时既遵循药物使用规范,同时也有一定的主观性。而其他国产PD-1厂商均表示,对超适应症用药这一问题不予置评。
如果说,超适应症使用是包括PD-1在内的肿瘤药的“水下竞争”,那么获批适应症数量的比拼则是看得见的PD-1们的竞赛。据研发客统计,国内获批适应症最多的是卡瑞利珠单抗,开展项目较多的适应症包括肝癌、食管癌、胃癌、乳腺癌和鼻咽癌;特瑞普利单抗开展项目较多的适应症有黑色素瘤、肝癌、鼻咽癌和乳腺癌;替雷利珠单抗是肝癌、食管癌、尿路上皮癌和胃癌;信迪利单抗则是淋巴瘤和食管癌。
记者|陈星 金喆 实习|林姿辰


